Marquage CE des dispositifs médicaux ou comment être en conformité au RDM européen
Une des composantes du référentiel HAS – Certification des PSDM, cf. un de nos articles publié dans notre précédente lettre en lien ICI
Le cadre réglementaire européen 2017 / 745
Le marquage CE a été créé dans le cadre de la législation d’harmonisation technique européenne. Il est basé sur une certification qui garantit que le dispositif médical répond à des exigences spécifiques de sécurité et de bénéfice clinique, fixées dans la réglementation européenne.
Depuis le 26 mai 2021, est entré en vigueur le règlement européen relatif aux dispositifs médicaux (RDM : Règlement du Conseil (UE) 2017/745 en lien), en remplacement de la directive relative aux dispositifs médicaux implantables actifs (Directive du Conseil (CEE) 90/385 en lien) et de la directive relative aux dispositifs médicaux (Directive du Conseil (CEE) 93/42 en lien).
Cette réglementation européenne vise à mettre en place la gestion des :
- Numéro IUD (Identifiant Unique du Dispositif)
- Opérations de maintenance et désinfection des dispositifs médicaux
- Certificats de marquage CE avec date de fin de validité
- Déclaration de conformité du fabricant avec logo CE + numéro organisme notifié
- L’accompagnement du DM par une notice (dans la langue du pays)
La démonstration de conformité est réalisée en conformité avec des normes techniques pour garantir des aspects tels la sécurité électrique, la stérilité ou la comptabilité biologique. Elle nécessite aussi de disposer de données cliniques. Le fabricant soumet son dispositif à une procédure d’évaluation de sa conformité décrite dans le règlement européen, excepté pour la classe I, afin d’y apposer le logo ‘CE’ lorsque la conformité est établie.
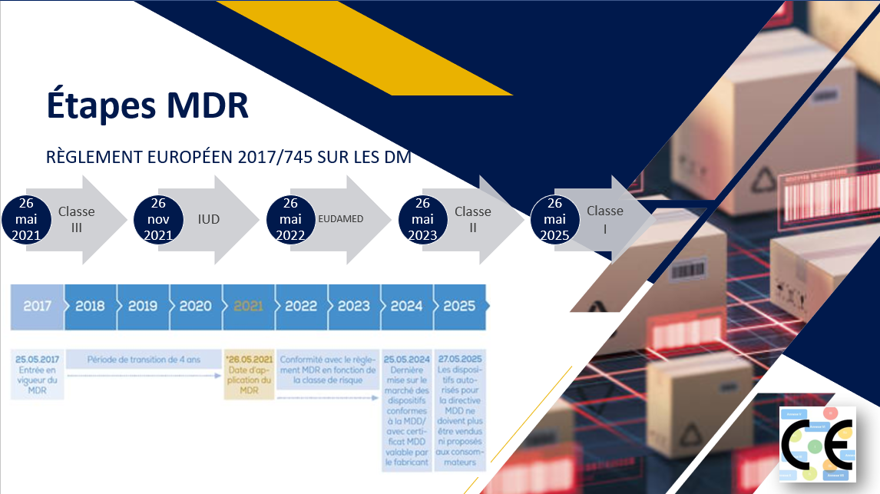
1) Délai de mise en œuvre en Europe
2) Gestion par classe de risque
Étant donné qu’il existe différentes classes de DM selon la durée d’utilisation, le type, les indications, les règles spécifiques réglementaires (médicaments), le MDR comporte plusieurs classes de risque.
Quelle que soit la classe, les exigences de démonstration de sécurité et de performances cliniques sont les mêmes. C’est la procédure d’évaluation de la conformité qui est adaptée en fonction de la classe de risque. La vérification de la conformité est réalisée par un Organisme Notifié. L’autorité compétente (en France, l’ANSM) est en charge de la surveillance des produits sur le marché.
Après les évaluations, le marquage CE sera apposé sur le produit avec la référence de l’organisme notifié. Tous les ans, des contrôles et renouvellements périodiques seront demandés.
IMPORTANT : les PSAD sont généralement concernés par les Classes I, IIa et IIb.
Pour les DM de classe I des dispositifs non invasifs (Fauteuils roulants par exemple) (non stérile et sans fonction de mesurage), il s’agit d’une auto-certification par le fabricant.
la classe I est elle-même subdivisé en 4 « sous-classes » :
- Classe I, dites simple : Tous les DM de classe I ne rentrant pas dans les classes suivantes
- Classe Is : Dispositifs médicaux de classe I vendu à l’état stérile
- Classe Im : Dispositifs médicaux de classe I avec une fonction de mesurage
- Classe Ir : Dispositifs médicaux de classe I réutilisable
Pour les classes IIa (PPC par exemple), IIb (Pompes à perfusions par exemple) ou III, une certification par organisme notifié est demandée selon :
- Évaluation du produit : exigences de sécurité et performances cliniques
- Évaluation du management : reproduire un produit identique et conforme
3) Quelles sont les obligations pour le PSAD
Avant de mettre un DM à disposition, le distributeur (un PSAD est un distributeur) doit vérifier que :
- Le dispositif porte le marquage CE
- Le DM est accompagné d’une notice et que la déclaration de conformité UE a été établie dans la ou les langue(s) officielle(s) dans lequel le DM est mis à disposition
- Le fabricant a attribué un IUD au dispositif
- Les documents soient bien remis au patient (notice et déclaration)
Vérifier les documents transmis
- Sigle CE sur la machine avec le n° de l’organisme
- Certificat de marquage CE (par fabricant)
- Étiquette et notice (dans la langue) du pays
- Déclaration de conformité CE (dans la langue par fabricant)
- N° IUD
- Informations de l’importateur présentes
Périodiquement : récupérer le nouveau certificat de marquage CE
4) Pour quels bénéfices ?
- L’identification des DM
- La traçabilité, la sécurité des approvisionnements et la lutte contre la contrefaçon
- La documentation sur l’utilisation d’un DM, pour le dossier patient et systèmes d’informations
- Pour le patient, les risques éventuels liés à l’utilisation du DM doivent être réduits au maximum et restés acceptable au regard du bénéfice clinique apporté au patient
- La prévention des erreurs médicales et les rapports d’incidents et la surveillance après-vente
- Les rappels de DM
5) Et concrètement… ce qu’il vous faudra faire avec votre logiciel
A partir du moment où le dispositif porte le marquage CE, votre logiciel de gestion devra idéalement intégrer les fonctionnalités permettant en particulier de :
- Ajouter le certificat de marquage CE du fabricant (validité maximale de 5 ans)
- Identifier un dispositif portant un marquage CE valide
- Lister les DM identifiés « Marquage CE »
- Connaître la validité du marquage CE
- Stocker les documents suivants (notice et déclaration CE/UE de conformité)
- Rechercher les fabricants : sans certificat, avec certificat, avec certificat expiré, avec certificat proche d’une certaine date d’expiration
- Attribuer une classe de risque au dispositif
- Modifier une classe pour un ensemble de DM
- Rechercher les articles d’une certaine classe de DM
- Renseigner pour identification en réception du dispositif
- Tracer la remise de notice du DM à l’utilisateur lors de la livraison d’un DM.
Pour tout renseignement complémentaire, merci de vous rapprocher de votre éditeur de logiciel métier.